Établir un compromis entre la taille des organes visuels et olfactifs est courant dans l’évolution animale mais les mécanismes génétiques et développementaux sous-jacents restent peu clairs. Une étude conduite par Ariane Ramaekers (Sorbonne Université) et Bassem Hassan (Inserm) à l’Institut du Cerveau révèle qu’un seul variant génétique, qui affecte le cours du développement des organes sensoriels chez la drosophile (mouche du vinaigre), pourrait expliquer le compromis établi entre la taille des yeux et des antennes. Il pourrait ainsi fournir une voie rapide pour les changements comportementaux et l’adaptation. De plus, le gène concerné, eyeless/Pax6, est conservé chez les invertébrés et les vertébrés, dont l’être humain. Cette découverte pourrait donc représenter un mécanisme général du compromis de la taille des organes sensoriels au sein du règne animal. Les résultats sont publiés dans la revue Developmental Cell.
Les sens des animaux ont évolué pour mieux naviguer et exploiter l’environnement. En résulte que même des espèces très proches, mais vivant dans des environnements différents, montrent des variations dans la taille et la forme de leurs structures sensorielles. Chez les arthropodes, comme la mouche du vinaigre, les compromis entre la taille des yeux et des antennes, où sont situés la majorité des organes olfactifs, sont omniprésents.
« Nous montrons dans cette étude qu’il existe des conséquences à des changements subtiles dans les mécanismes conservés qui gouvernent le développement des organes sensoriels » explique Bassem Hassan, dernier auteur de l’étude et chef de l’équipe « Développement du cerveau » à l’Institut du Cerveau - ICM. « D’une manière plus générale, cela signifie qu’il est impossible de comprendre totalement les liens entre les variations génétiques et morphologiques sans comprendre les processus développementaux qui conduisent de l’un à l’autre. »
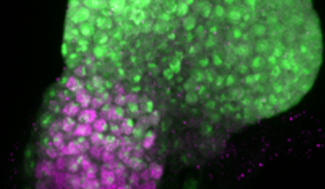
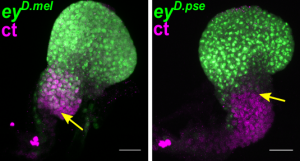
Pour comprendre ces mécanismes, Bassem Hassan et Ariane Ramaekers ont combiné des analyses comparatives de différentes espèces et souches de drosophile avec des approches développementales, moléculaires et génomique. Les auteurs se sont plus spécifiquement concentrés sur une structure appelée le disque imaginal œil-antenne (eye-antennal imaginal disc, EAD), composée d’un champ visuel et d’un champ non-visuel, et à l’origine de tous les organes sensoriels externes de la tête chez la drosophile au cours du développement.
Les chercheurs ont mis en évidence que le champ visuel est proportionnellement plus grand chez Drosophila pseudoobscura (D. pse.)que chez Drosophila melanogaster (D. mel.), avec une augmentation de 35% du nombre d’ommatidies – les petites unités composant l’œil de la mouche. De façon similaire, le champ visuel est proportionnellement plus grand chez une souche de D. mel.appelée Canton-S comparée à la souche de D. mel.Hikone-AS, avec une augmentation de 12,5% du nombre d’ommatidies.
« Ces données suggèrent que malgré 17 à 30 millions d’années d’évolution distincte de ces deux espèces, la variation du nombre d’ommatidies entre D. mel. Et D. pse. et entre les deux souches de D. mel., partage une même logique d’un point de vue développemental. » poursuit Bassem Hassan.

Afin d’élucider les causes génétiques de la variation de la taille des yeux, les chercheurs ont examiné les séquences ADN sur lesquelles se fixent des protéines particulières, les facteurs de transcriptions, pour réguler l’expression du gèneeyeless/Pax6. Ils ont identifié une unique variation génétique, une substitution d’un nucléotide G en A au niveau d’un site de fixation, qui différencient les espèces avec des yeux de grande taille ou de petite taille. Cet allèle G, chez les espèces possédant des yeux de taille inférieure, est supposé avoir une meilleure affinité avec le site de liaison, conduisant à une plus grande répression de l’expression du gène eyeless/Pax6 par rapport à l’allèle A chez les espèces aux yeux de grande taille.
Des analyses complémentaires ont montré que ce variant était présent dans des populations naturelles de drosophiles, et que l’allèle A correspond à un nombre augmenté d’ommatidies et des antennes de largeur réduite chez les différentes souches de laboratoire. Grâce à la technologie Crispr/Cas9, les chercheurs ont pu introduire un allèle A au sein d’une population uniquement porteuse de l’allèle G et ont mis en évidence que cette substitution G>A augmentait le nombre d’ommatidies.
« Nous avons été surpris par la simplicité du mécanisme de compromis sensoriel que nous avons identifié. Pour faire varier la taille des organes sensoriels, les yeux contre les antennes dans le cas présent, il suffit de faire varier un peu l’expression d’un seul gène. » souligne Ariane Ramaekers, première auteur de l’étude. « Il est particulièrement intéressant que ce gène, Pax6, soit le même qui construit les yeux de tous les animaux dont l’être humain. Nous avons aussi été surpris de voir que ce qui compte pour générer le compromis est quand, et non où, le gène Pax6 est exprimé. Pour modifier la taille des yeux, il suffit d’accélérer ou de ralentir légèrement la subdivision du primoridum de la tête entre les territoires visuels et non-visuels. »
Pour les auteurs, ces résultats soulèvent plusieurs questions intéressantes, par exemple comment ce variant modifie le cours de l’expression de Pax6et le développement des organes sensoriels. De plus, il est possible que modifier la temporalité de l’expression de gènes clés du développement puisse être une règle générale pour faire varier la taille d’un tissu ou d’un organe. Enfin, un autre questionnement important est de savoir si les changements relatifs de taille des organes sensoriels affectent les régions sensorielles du cerveau.
Ce travail est soutenu par le VIB, le Belspo WiBrain Interuniversity Attraction Pole network, le Fonds Wetenschappelijke Onderzoeks (FWO), l’Institut Hospitalo-Universitaire (IHU), l’Institut du Cerveau et de la Moëlle Epinière (Institut du Cerveau - ICM), le FLiACT Marie Curie ITN, et une bourse de la Swiss National Science Foundation (SNSF).
Sources
Developmental Cell, Ramaekers et al.: “Altering the temporal regulation of one transcription factor drives evolutionary trade-offs between head sensory organs” https://www.cell.com/developmental-cell/fulltext/S1534-5807(19)30658-6D… 10.1016/j.devcel.2019.07.027