A l’Institut du cerveau, Anne BARON-VAN EVERCOOREN, directrice de recherche émérite (INSERM) dans l’équipe co-dirigée par Brahim NAIT-OUMESMAR et Violetta ZUJOVIC, concentre ses recherches sur les oligodendrocytes, cellules du système nerveux central essentielles à la formation de la myéline et à la réparation des lésions de sclérose en plaques.
Dans le cadre d’un consortium international*, Anne BARON-VAN EVERCOOREN et ses collaborateurs viennent de publier 2 articles scientifiques concluant que les oligodendrocytes des patients atteints de SEP ne présentent aucun défauts intrinsèques,, ouvrant ainsi la voie à de nouvelles perspectives thérapeutiques pour les formes rémittentes de sclérose en plaques.
La sclérose en plaques (SEP) est une maladie inflammatoire autoimmune du système nerveux central qui se caractérise par des lésions, « les plaques » dans lesquelles la gaine protectrice et nourricière des neurones « la myéline » devient la cible des cellules immunitaires entrainant sa destruction.
La perte de la myéline, composant d’autre part indispensable à la transmission de l’influx nerveux, conduit à une dégénérescence des neurones, bloquant la communication entre le cerveau et les organes périphériques et conduisant à un handicap irréversible chez les patients.
Les thérapies actuelles visent à diminuer la réaction inflammatoire (immunitaire) mais l’identification de capacités intrinsèques à réparer leurs lésions chez certains patients oriente plus encore les recherches d’aujourd’hui vers des stratégies de remyélinisation.
La question essentielle à laquelle les travaux d’Anne BARON-VAN EVERCOOREN et de ses collaborateurs tentent de répondre repose sur les mécanismes cellulaires au sein même des lésions qui pourraient conduire à un échec de la réparation de la myéline, et en particulier sur la capacité des oligodendrocytes d’assurer leur rôle réparateur.
Depuis plusieurs années, la technologie des cellules souches pluripotentes humaines (iPSC) se développe et progresse permettant aujourd’hui de générer différents types cellulaires, y compris des oligodendrocytes, à partir de cellules de peau (biopsie) de patients.
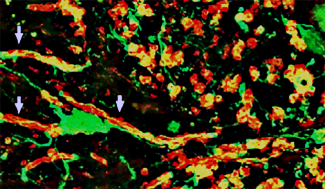
Grâce à cette technologie les équipes d’Anne BARON-VAN EVERCOOREN (Institut du Cerveau) et de Tanja Kuhlmann (Münster) ont comparé des oligodendrocytes dérivés de cellules de peau de patients SEP, dont deux paires de jumeaux monozygotes discordants pour la SEP et d’individus sains contrôles.
L’équipe de Tanja Kuhlmann a mis en évidence que des progéniteurs d’oligodendrocytes dérivés de patients atteints de SEP se différencient in vitro en oligodendrocytes de façon identique que ceux issus des individus contrôles. En revanche, leur différenciation en oligodendrocytes et donc potentiellement leur capacité de remyélinisation sont affectées par un environnement inflammatoire tel que celui observé dans les lésions de SEP.
Anne BARON-VANEVERCOOREN et son équipe montre en parallèle que lorsque ces mêmes cellules sont greffées dans un modèle expérimental présentant un défaut de myéline, les progéniteurs d’oligodendrocytes de patients atteints de SEP interagissent fonctionnellement avec les cellules gliales (astrocytes et oligodendrocytes) du cerveau, et myélinisent les axones en rétablissant la conduction nerveuse avec la même efficacité que ceux issus des individus contrôles.
Ces découvertes combinées indiquent que le défaut de remyélinisation existant chez certains patients atteints de sclérose en plaques de forme remittente, n’est pas lié à un défaut intrinsèque des oligodendrocytes, cellules myélinisantes du cerveau, mais à l’environnement toxique et inflammatoire des lésions.
* Anne Baron-Van Evercooren et le Prof. Kuhlmann (Milan) sont co-investigateurs d’un “réseau de recherche collaboratif » coordonné par G. Martino (Milan) et financé par le prix “International Progressive MS Alliance” en 2016.
Sources
Starost L, Lindner M, Herold M, Kang T, Drexler HCA, Heß K, Ehrlich M, Ottoboni L, StehlingM, Röpke A, Thomas C, Schöler HR,Antel J, Winkle J, Martino G*, Klotz L*, Kuhlmann T*. Extrinsic immune cell-derived, but not intrinsic oligodendroglial factors contribute to oligodendroglial differentiation block in multiple sclerosis. *shared last authorship. Acta Neuropathol. 2020 Nov;140(5):715-736. https://doi.org/10.1007/s00401-020-02217-8