Aucun traitement capable de stopper la progression silencieuse de la sclérose en plaques n’existe à l’heure actuelle, et de nombreux médicaments prometteurs se sont révélés inefficaces lors de leur évaluation clinique. Pour réduire ce taux d’échec et mieux prédire le potentiel des molécules candidates, des chercheurs de l’Institut du Cerveau coordonnés par Bernard Zalc ont mis au point un nouveau modèle de la maladie, décrit dans la revue Brain. Il permet de corréler précisément la dégénérescence ou la régénération de la myéline à l’évolution des capacités cognitives et motrices. A l’horizon : un meilleur ciblage des molécules susceptibles de favoriser la remyélinisation et de stopper l’évolution de la maladie.
Dans la sclérose en plaques (SEP), le système immunitaire s’attaque par erreur au cerveau et à la moelle épinière, en provoquant par endroits la perte complète de la myéline, la gaine protectrice qui enveloppe les fibres nerveuses et est indispensable à leur bon fonctionnement.
« Synthétisée par des cellules spécialisées, les oligodendrocytes, la myéline protège les fibres nerveuses, garantit la bonne conduction de l’influx nerveux et fournit des nutriments aux axones. Sa disparition, appelée démyélinisation, provoque des symptômes sensoriels et moteurs : faiblesse des membres inférieurs ou supérieurs, perte d’équilibre, troubles de la sensibilité et de la vision. »
Au cours des trente dernières années, des progrès thérapeutiques considérables ont été réalisés pour contrôler la composante inflammatoire de la sclérose en plaques, et ainsi réduire les dégâts causés par le système immunitaire lors des phases de poussées de la maladie. Mais malgré ces avancées, on observe toujours une progression du handicap chez les patients, pourtant traités avec des immunothérapies efficaces. La raison ? Une neurodégénérescence largement indépendante de l’inflammation… qui justifie le besoin de traitements réparateurs.
Or, la réparation des lésions de la gaine de myéline – ou remyélinisation – est un véritable défi. Les échecs cliniques se sont multipliés au cours des années.
« Pourquoi les molécules candidates nous déçoivent-elles systématiquement lorsqu’elles sont testées chez l’humain ? Il y a une explication possible : au stade préclinique, on les évalue sur leur capacité à générer de nouvelles cellules productrices de myéline. Ce critère, basé sur l’observation des tissus, ne suffit pas. Pour que le médicament soit efficace, il doit également améliorer les symptômes de la maladie, voire rétablir complètement les capacités sensorielles et motrices. Mais à l’heure actuelle, il est difficile de faire le lien entre une lésion de démyélinisation donnée et un déficit sensorimoteur spécifique. »
Un pont entre lésions et comportement
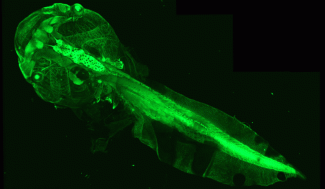
Pour pallier ce manque, les chercheurs de l’équipe de Catherine Lubetzki et Bruno Stankoff à l’Institut du Cerveau ont imaginé un nouvel outil. Ils ont utilisé des têtards génétiquement modifiés de xénope, un amphibien qui à ce stade de développement possède un corps parfaitement transparent. Cette particularité permet de compter facilement, au sein du nerf optique, le nombre d’oligodendrocytes producteurs de myéline, puis de corréler cet indicateur aux capacités motrices et comportementales de l’animal.
Parce que la variation du nombre d’oligodendrocytes indique un processus de démyélinisation ou de remyélinisation, l’équipe a mis au point un procédé permettant de provoquer ces événements sur demande : les chercheurs ont introduit dans l’aquarium des têtards une substance appelée métronidazole, qui, dans les conditions où elle est utilisée, provoque la perte des oligodendrocytes dans le nerf optique des animaux. Cette perte était corrélée à l’altération des capacités visuelles – évaluées par un test d’évitement d’une cible virtuelle.
Une fois l’exposition au métronidazole terminée, les chercheurs ont constaté une réparation spontanée de la myéline, mesurée par l’augmentation du nombre d’oligodendrocytes et une amélioration des résultats du test visuel. Ils ont alors montré que ce phénomène peut être accéléré en présentant aux têtards des molécules favorisant la remyélinisation.
« Nos résultats montrent que la variation des performances motrices et sensorielles est parfaitement corrélée au niveau de démyélinisation et à la remyélinisation des tissus. Ce modèle est idéal pour tester le potentiel de remyélinisation de nouveaux médicaments avant de lancer des tests cliniques longs et coûteux ».
Il est en effet urgent de trouver des molécules capables d’agir sur la démyélinisation, qui, sous sa forme chronique, induit des lésions des axones irréversibles et responsables de la mort neuronale. Le handicap progresse alors inexorablement.
« Ce nouvel outil, qui permet un suivi in vivo, a le potentiel de faire progresser nos connaissances sur le lien entre troubles visuels – l’un symptômes les plus fréquents de la sclérose en plaques – et lésions de démyélinisation associées. C’est un vrai tremplin pour de futurs succès thérapeutiques. »
Financements :
Cette étude a été réalisée grâce au financement du programme Investissements d’avenir le programme de recherche et d’innovation Horizon 2020 de l’Union européenne, le projet ENDpoiNTs la subvention BRECOMY de la DFG et l’ANR, la subvention MADONA de l’ANSES et la subvention IONESCO de NeurATRIS.
Sources
Henriet. et al. Monitoring recovery after CNS demyelination, a novel tool to de-risk pro-remyelinating strategies. Brain (2023) Mar 30:awad051. doi.org/10.1093/brain/awad051