De la performance des plateformes technologiques dépend la qualité des découvertes scientifiques. Révolutionnaire dans sa conception, innovant dans son organisation, l’Institut du Cerveau – ICM est aussi unique par ses équipements technologiques de pointe.
Le pôle d’Imagerie par Résonance Magnétique
dirigé par Stéphane Lehéricy
Les chercheurs du pôle d’Imagerie par Résonance Magnétique s’intéressent à la physiopathologie c’est-à-dire à élucider les processus pathologiques qui se développent dans le cerveau. Ces études concernent les grandes pathologies du système nerveux :
• les démences (maladie d’Alzheimer et autres démences dégénératives),
• la sclérose en plaques,
• l’épilepsie,
• les pathologies du mouvement (maladie de Parkinson, dystonies, sclérose latérale amyotrophique),
• la chirurgie tumorale,
• la psychiatrie (dépression, émotion, TOC).
Le Centre de Recherche de Neuro-imagerie de l’Institut du Cerveau – ICM utilise trois dispositifs principaux d’analyse du cerveau par IRM : l’IRM anatomique, l’IRM fonctionnelle et l’IRM de diffusion. Dans les trois cas, le cerveau est soumis à un champ magnétique extérieur.
Le Centre de Recherche de Neuroimagerie de l’Institut du Cerveau – ICM, CENIR, est une plateforme regroupant des outils de neuro-imagerie les plus puissants actuellement disponibles. Ils sont entièrement dédies aux neurosciences intégratives, cognitives et cliniques et permettent aux chercheurs de l’Institut de mener une recherche transversale et pluridisciplinaire. Le CENIR, également accessible aux chercheurs et hospitaliers extérieurs à l’Institut du Cerveau – ICM, possède des équipements extrêmement sophistiqués permettant une investigation clinique et une recherche de pointe : des appareils d’imagerie par résonance magnétique (IRM) à 3 Tesla chez l’homme et à 11,7 Tesla chez le petit animal, des appareils de neurophysiologie avec un magnétoencéphalographe (MEG) et des systèmes d’électro-encéphalographie (EEG) et enfin de stimulation magnétique transcrânienne (TMS).
Le dispositif d’IRM anatomique permet par exemple de mettre en évidence des tumeurs cérébrales, certaines malformations ou d’autres anomalies structurelles dues à une dégénérescence ou à un traumatisme.
A l’Institut du Cerveau – ICM, La plateforme STIM, dirigée par Jérome Yelnik, a pour objectif de regrouper les personnes, les outils, les projets autour de la stéréotaxie. La stéréotaxie consiste à se repérer précisément dans l’espace, ce qui permet par exemple en neurochirurgie, de se positionner très précisément dans le cerveau du patient. Dans le cas de la maladie de Parkinson, la stimulation cérébrale profonde est effectuée en conditions stéréotaxiques (visuel ci-contre), tout comme l’implantation d’électrodes d’enregistrement chez des patients épileptiques pharmaco-résistants. Au sein de l’Institut du Cerveau – ICM, un certain nombre d’équipes travaillent à l’aide de données stéréotaxiques.
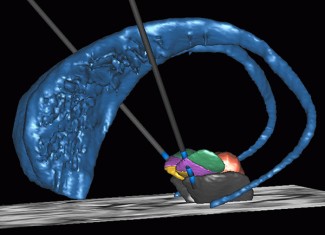
La plateforme STIM est donc impliquée dans de nombreux projets développés à l’Institut du Cerveau – ICM, à travers des collaborations avec l’équipe codirigée par Luc Mallet et Jérôme Yelnik sur le traitement des « TOC », la plateforme d’électrophysiologie de l’IHU-A-Institut du Cerveau – ICM, l’équipe COGIMAGE (Neurosciences cognitives et Imagerie cérébrale) codirigée par Olivier Colliot et Nathalie George, l’équipe de Etienne Hirsch (Thérapeutique expérimentale de la neurodégénérescence).
L’IRM fonctionnelle permet de suivre en direct l’activité du cerveau. Elle s’appuie sur les mêmes principes de base que l’IRM anatomique mais les mesures reflètent cette fois les propriétés d’aimantation de l’hémoglobine contenue dans les globules rouges du sang, propriétés qui varient selon que l’hémoglobine est oxygénée ou désoxygénée (phénomène d’hémodynamisme). Les neurones activés consomment de l’énergie et un afflux de sang oxygéné leur parvient. Lorsque le cerveau est soumis à un champ magnétique extérieur, les images vont présenter des contrastes suivant que les régions sont activées ou non et ce grâce à la variation de l’hémodynamisme. L’acquisition d’images permet de suivre en temps réel les modulations du débit sanguin liées à l’activité cérébrale d’une tâche cognitive par exemple.
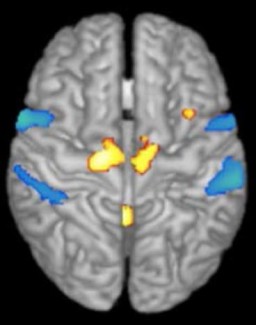
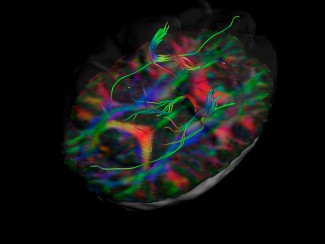
L’IRM de diffusion est à ce jour la seule technique qui permet d’observer la connectivité cérébrale de manière non invasive. Elle est donc utilisée aussi bien dans des études sur l’animal que sur l’homme notamment en complément de l’IRM fonctionnelle. Elle permet de calculer en chaque point de l’image la distribution des directions de diffusion des molécules d’eau. Cette diffusion étant contrainte par les tissus environnants, cette modalité d’imagerie permet d’obtenir indirectement la position, l’orientation de substance blanche cérébrale, notamment les faisceaux des axones du cerveau. En clinique, cette technologie indique la localisation des faisceaux touchés par une lésion dans la matière blanche (par exemple une plaque de sclérose en plaques) ou la localisation de tumeurs par rapport aux faisceaux de matière blanche environnants.
A l’Institut du Cerveau – ICM, l’équipe de Laurent Cohen utilise l’IRM de diffusion pour l’élucidation des mécanismes mis en jeu dans la lecture et l’écriture.
Un des axes de recherche qui se développe au CENIR, en collaboration avec les équipes travaillant sur les mécanismes des maladies neurodégénératives, est la mise en évidence de marqueurs de pathologie qui peuvent être utilisés pour le pronostic, le diagnostic ou le suivi d’un traitement. Par exemple, la collaboration entre l’équipe de Stéphane Lehéricy et l’équipe d’Alexis Brice a permis d’identifier le fer comme biomarqueur d’une maladie de Parkinson débutante. Les propriétés d’aimantation de l’atome de fer sont utilisées pour quantifier le fer libre par IRM. Plus la concentration de fer libre est importante, plus le signal IRM est faible, signal mesuré par rapport à un individu sain. Lors d’un processus d’inflammation, les neurones attirent le fer dans leur milieu intracellulaire. La concentration intracellulaire du fer dans le neurone n’est pas compensée par une surexpression d’une protéine appelée Ferritine capable de piéger le fer libre. Ce dernier présent dans les neurones est neurotoxique. La mesure indirecte du fer peut donc être considérée comme un marqueur précoce de la maladie de Parkinson.
La recherche sur le traitement du signal et de l’image représente une condition indispensable à l’essor de l’imagerie neurofonctionnelle. L’équipe de recherche méthodologique dirigée par Olivier Colliot développe de nouvelles méthodes pour analyser des images grâce à des outils d’informatique et de mathématiques appliquées. Il s’agit de transformer les données des images acquises en des représentations quantifiées, traitées d’un point de vue statistique puis analysées.
Le pôle de Magnétoencéphalographie et Electroencéphalographie
dirigé par Nathalie George
Les techniques d’électrophysiologie comme l’électroencéphalographie (EEG), la magnétoencéphalographie (MEG) et l’électroencéphalographie stéréotaxique (SEEG) sont complémentaires des techniques IRM.
Elles apportent des renseignements sur l’activité du cerveau avec une excellente résolution temporelle, en enregistrant directement les potentiels électriques et le champ magnétique qui découlent de l’activité électrique du cerveau.
Elles permettent ainsi d’étudier les bases neurales de la pensée, des émotions, du comportement et du vieillissement, dans des situations normales et pathologiques. En EEG et MEG, les enregistrements sont réalisés à un niveau macroscopique, à la surface de la tête.
Grâce aux capteurs d’une grande sensibilité, on peut suivre l’activité électrique milliseconde après milliseconde et recueillir soit le potentiel électrique soit le champ magnétique généré. Les champs magnétiques émanant de l’activité électrique des neurones sont très faibles, un milliard de fois plus faibles que le champ magnétique terrestre. L’Institut du Cerveau – ICM a accueilli un capteur MEG de dernière génération pour lequel le Centre MEG-EEG est pilote au niveau mondial. L’ensemble des moyens de neuro-imagerie ainsi réunis constitue une plateforme technologique intégrée unique et de très haut niveau.
La MEG détecte la somme des champs magnétiques produits par l’activité électrique de plusieurs dizaines de milliers de neurones, enregistrée par des centaines de points de mesure à la surface du cortex cérébral. L’EEG permet aussi de visualiser l’activité électrique du cortex mais les signaux sont déformés par leurs passages dans les différentes couches de tissus comme les méninges, les os du crâne et la peau. Par contre les champs magnétiques ne sont pas déformés par les tissus si bien que les signaux captés par la MEG fournissent des informations plus précises sur la localisation de l’activité cérébrale. Les données obtenues par l’EEG et la MEG peuvent être superposées à des images d’IRM anatomique ou fonctionnelle, ce qui permet de localiser milliseconde après milliseconde les régions du cortex en activité.
La MEG et l’EEG sont couramment utilisés en clinique pour localiser les foyers épileptiques. A l’Institut du Cerveau – ICM, Nathalie George s’intéresse à caractériser le flux d’information dans le cerveau au cours du traitement des informations émotionnelles et sociales, par exemple lors de l’exécution d’une tâche cognitive ou dans la dépression.
Elle a mis en évidence une influence extrêmement précoce des informations émotionnelles associées à un visage sur les réponses cérébrales. Au sein de son équipe, Jean Lorenceau a mis au point un système qui permet de contrôler de façon volontaire les mouvements de poursuite oculaire et de développer sur cette base une technologie pour tracer des trajectoires lisses et claires avec les yeux, et ainsi « d’écrire avec les yeux ». L’équipe de Laurent Cohen et de Lionel Naccache développe des mesures électrophysiologiques de l’état de conscience, calculées de façon continue en temps réel, à partir d’EEG à haute résolution spatiale. Ce dispositif vise également à explorer les fluctuations de conscience de patients non-communicants (coma, état végétatif) : grâce aux techniques d’EEG, de MEG, d’électroencéphalographies stéréotaxiques (SEEG) et d’imagerie par résonance magnétique fonctionnelle, cette équipe a finalisé plusieurs études diagnostiques et pronostiques sur les signatures électrophysiologiques de la conscience chez plus de 200 patients, le plus grand groupe de malades non communicants jamais étudié à ce jour.
“L’ensemble de ces techniques permettent de mieux comprendre les maladies du cerveau et de la moelle épinière et ainsi d’espérer la mise au point rapide de traitements pour les lésions du système nerveux afin de les appliquer Pr Alexis Brice, aux patients dans les meilleurs délais.“
Le pôle de Stimulation Magnétique Transcrânienne (TMS)
dirigé Traian Popa et Sabine Meunier
La stimulation magnétique transcrânienne est une méthode d’exploration du cortex. Lors de la neuronavigation, la TMS est couplée l’IRM anatomique. La surface du cerveau, repérée grâce à l’IRM, est soumise à un courant électrique, le champ magnétique créé traverse les os du crâne sans distorsion et va stimuler la région concernée en produisant à son tour un courant électrique. La stimulation dans le cortex reste superficielle (environ 2 à 3 cm sous la surface du crâne) et, bien qu’appliquée sur une région définie, se propage sur un grand réseau cortical.
La TMS est couramment utilisée pour l’étude de la plasticité cérébrale : à l’Institut du Cerveau – ICM, Sabine Meunier dans l’équipe de Marie Vidailhet et son équipe utilise l’exploration par IRM et la stimulation magnétique transcrânienne pour caractériser finement les circuits cérébraux mis en jeu dans le contrôle du mouvement normal et pathologique (dystonies, la maladie de parkinson, le syndrome de Gilles de la Tourette, tics simples et complexes, troubles obsessionnels compulsifs…).
Un objectif majeur de l’équipe est de développer des thérapies non invasives : les stimulations électriques et magnétiques des structures cérébrales dysfonctionnelles favorisent la plasticité cérébrale et luttent contre les symptômes invalidants de certains patients. Le professeur Bruno Dubois et son équipe, ont récemment mené une étude sur des patients amnésiques. En utilisant l’IRM et la magnétoencéphalographie (MEG), ils ont précisé le rôle de l’hippocampe dans la mémoire épisodique et dans des phénomènes complexes d’hallucinations. Grâce à l’interaction entre l’observation clinique de patients cérébro-lésés et le plateau technique exceptionnel qu’offre le CENIR, l’équipe de Bruno Dubois a pu progresser dans la connaissance des grandes fonctions du cerveau et de leur dysfonctionnement au cours des pathologies dégénératives, en particulier la maladie d’Alzheimer.