Plusieurs études de l’équipe du Pr Bruno Stankoff « La remyélinisation dans la sclérose en plaque : de la biologie à la translation clinique », mettent en évidence de nouveaux mécanismes d’inflammation cérébrales dans la sclérose en plaques, grâce à de nouveaux outils d’imagerie basés sur la combinaison de l’imagerie par résonance magnétique (IRM) et de la tomographie par émission de positrons (TEP).
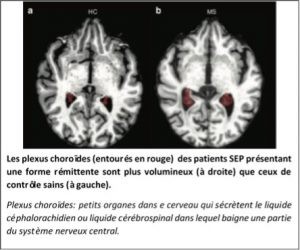
Grâce à la TEP-IRM, l’équipe du Pr Stankoff vient de publier dans la revue Radiology, les résultats d’une étude portant sur 97 patients atteints de SEP et 44 contrôles sains démontrant des anomalies (augmentation de volume et inflammation) au sein des plexus choroïdes chez les patients. Les plexus choroïdes sont des structures localisées dans les ventricules cérébraux responsables de la production de liquide cérébro-spinal, et agissant comme une barrière entre le système nerveux et le système immunitaire.
Ces anomalies des plexus choroïdes étaient corrélées à l’inflammation du cerveau, témoignant de l’activité de la maladie. Ces résultats ouvrent une nouvelle voie vers une application de l’imagerie de cette structure comme marqueur de la réponse immunitaire dans le cerveau, et pointe les plexus choroïdes comme un acteur important de la physiopathologie de la maladie.
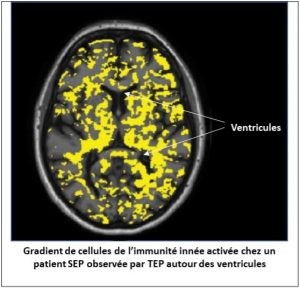
Des travaux de la même équipe publiés dans la revue Neurology, montrent une activation des cellules de l’immunité innée associée à des microlésions de la substance blanche chez des patients atteints de SEP dont le handicap s’aggrave, et que cette activation immunitaire suit un gradient centré autour des ventricules cérébraux, qui contiennent le liquide céphalo-rachidien.
Ces résultats obtenus grâce à la combinaison de la TEP ciblant les cellules de l’immunité innée et de l’IRM confirment l’existante d’une corrélation entre l’activation de ces cellules autour des ventricules, zones privilégiées des lésions de SEP en contact avec le liquide céphalorachidien (LCR), et l’aggravation du handicap chez les patients. Ceci suggère que des molécules contenues dans le LCR pourrait aggraver l’inflammation présente dans la substance blanche des patients et donc favoriser une évolution délétère de la maladie, rendant ces molécules candidates pour de futurs recherches de traitements.
Sources
https://pubmed.ncbi.nlm.nih.gov/33737372/
Poirion E, Tonietto M, Lejeune FX, Ricigliano VAG, Boudot de la Motte M, Benoit C, Bera G, Kuhnast B, Bottlaender M, Bodini B, Stankoff B. Neurology. 2021 Apr 6;96(14):e1865-e1875.
https://pubmed.ncbi.nlm.nih.gov/34254858/
Ricigliano VAG, Morena E, Colombi A, Tonietto M, Hamzaoui M, Poirion E, Bottlaender M, Gervais P, Louapre C, Bodini B, Stankoff B. Radiology. 2021 Oct;301(1):166-177.
https://pubmed.ncbi.nlm.nih.gov/34545219/
Bodini B, Tonietto M, Airas L, Stankoff B. Nat Rev Neurol. 2021 Sep 20.