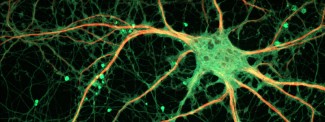
La sclérose en plaques est une maladie inflammatoire du système nerveux central entrainant une progressive destruction de la gaine de myéline entourant les axones, indispensable à leur protection et à la transmission de l’influx nerveux. L’équipe de Bruno Stankoff et Catherine Lubetzki a mis au point une nouvelle méthode d’imagerie permettant de visualiser la démyélinisation et de la remyélinisation des neurones et de quantifier leur dégénérescence. Ces résultats, publiés dans la revue Annals of Neurology, ouvrent la voie à une meilleure prise en charge thérapeutique des patients et à l’évaluation de nouvelles thérapies remyélinisantes.
Les axones, prolongements des neurones, sont entourés par une gaine de myéline qui joue un rôle clé dans la transmission de l’influx nerveux et dans la protection des axones. Dans le cas de la sclérose en plaques, le système immunitaire attaque les propres éléments de l’individu et entraîne la destruction progressive de la gaine de myéline ou démyélinisation, au niveau du cerveau et de la moelle épinière.
La sclérose en plaques est une maladie inflammatoire auto-immune. C’est la maladie démyélinisante du système nerveux central la plus fréquente et la première cause de handicap sévère d’origine non traumatique chez le jeune adulte. Elle entraîne des troubles moteurs, sensitifs, de l’équilibre, visuels… Elle touche environ 100 000 personnes en France et plus de 2,8 millions dans le monde. Les femmes sont beaucoup plus touchées par la maladie avec un ratio de 3 femmes pour 1 homme.
La quantification de la démyélinisation et de la remyélinisation chez les patients atteints de sclérose en plaques est essentielle pour mieux comprendre comment se développe la maladie et pour évaluer d’éventuelles thérapies remyélinisantes. L’utilisation de la tomographie par émission de positons ou TEP (technique d’imagerie médicale) associée à certaines molécules spécifiques appelées traceurs pourrait permettre l’observation de la dynamique de la myéline dans la sclérose en plaques.
Les chercheurs de l’équipe de Bruno Stankoff et Catherine Lubetzki se sont intéressés à deux radiotraceurs en particulier : le [11C] PiB, dont ils ont démontré qu’il se fixe sur la myéline de la substance blanche, et le [11C] flumazenil, une molécule se fixant sur des récepteurs GABA-A spécifiques des neurones.
Ils ont montré une diminution progressive de la liaison de [11C] PiB entre la substance blanche non endommagés et les lésions de substance blanche causées par la sclérose en plaque, reflétant une diminution de la myéline. L’utilisation de [11C] PiB permettrait de quantifier la dynamique de la myéline dans la sclérose en plaques, c’est-à-dire la démyélinisation et la remyélinisation et de catégoriser les patients selon leur potentiel de remyélinisation spontanée pour adapter les traitements.
Les chercheurs de de l’équipe de Bruno Stankoff et Catherine Lubetzki se sont également penchés sur la dégénérescence des neurones chez les patients atteints de sclérose en plaques à différents stades de la maladie, en utilisant le [11C] flumazenil en Tomographie par émission de positons.
Le flumazenil est une molécule capable de se fixer sur un récepteur présent au niveau des synapses des neurones, la zone de contact entre deux neurones et des dendrites. Ils ont montré que la liaison du flumazenil sur son récepteur diminue significativement chez les patients atteints de sclérose en plaques, aussi bien dans les formes récurrentes-rémittentes, où les crises sont alternées avec des phases de rémissions avec amélioration des symptômes que dans les formes progressives où il n’y a pas de phases de rémission.
Ces résultats ouvrent la voie à une possible utilisation de la TEP avec le [11C] flumazenil pour cartographier et quantifier la dégénérescence des neurones chez les patients atteints de sclérose en plaques. Cette technique de quantification pourrait également présenter un intérêt pour l’évaluation de médicaments neuro-protecteurs lors d’essais cliniques.
Sources
https://pubmed.ncbi.nlm.nih.gov/26292991/ Annals of Neurology, 21 août 2015
https://pubmed.ncbi.nlm.nih.gov/27098444/ Annals of Neurology, 21 avril 2016.