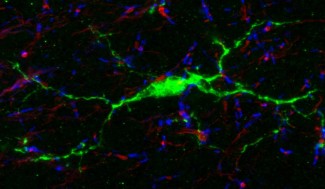
Le cerveau révèle petit à petit les mystères de son fonctionnement. Outre l’étude des neurones, les chercheurs s’intéressent de plus en plus au rôle d’autres types de cellules du système nerveux qui aident les neurones dans leurs tâches quotidiennes. Une étude conduite par des chercheurs de l’Inserm, du CNRS, de l’AP-HP et de Sorbonne Université, regroupés au sein de l’Institut du Cerveau à l’hôpital Pitié-Salpêtrière AP-HP, montre pour la première fois une interaction entre les neurones et les microglies, des cellules immunitaires présentes dans le cerveau. Ce mode de communication jusqu’alors inconnu pourrait être clé pour mieux comprendre les mécanismes de réparation du cerveau ainsi que des pathologies comme la sclérose en plaques. Les résultats font l’objet d’une publication dans la revue Nature Communications.
Dans notre système nerveux, la transmission de l’influx nerveux (messages nerveux) se fait par le biais des prolongements des neurones, les axones, entourés d’une gaine isolante appelée myéline. Les nœuds de Ranvier, de petits domaines intercalés entre les segments de myéline sont indispensables pour la diffusion rapide de l’information, mais ils sont aussi une plaque tournante d’interactions cellulaires dans le cerveau.
Des études antérieures avaient déjà montré que certains types de cellules du cerveau, comme les oligodendrocytes et les astrocytes, formaient des contacts avec les neurones au niveau de ces nœuds de Ranvier. En revanche, les interactions avec un autre type de cellules essentiel du cerveau, les microglies, n’avait pas été explorées. Ces cellules immunitaires jouent pourtant un rôle clé de protection du cerveau ainsi que dans des processus régénératifs comme la remyélinisation, la reformation de la gaine de myéline, qui est atteinte dans des pathologies comme la sclérose en plaques.
Une étude conduite à l’Institut du Cerveau par la chercheuse Inserm Anne Desmazières et ses collègues Rémi Ronzano et Thomas Roux dans l’équipe de Catherine Lubetzki (AP-HP/Sorbonne Université) montre pour la première fois que des contacts et une communication existent entre les neurones et les cellules microgliales au niveau des nœuds de Ranvier.
Grâce à des études menées sur des modèles murins ex-vivo (cultures tissulaires) et in-vivo, notamment par des approches d’imagerie en temps réel permettant d’observer la dynamique de ces contacts, mais également sur du tissu humain, les chercheurs ont révélé une interaction particulièrement stable entre ces deux types de cellules, et un dialogue renforcé dans un contexte de régénération de la myéline. Ils ont également identifié les mécanismes sous-jacents à ce dialogue. C’est l’activité neuronale qui est le médiateur de l’interaction et la renforce. Les microglies sont capables de « lire » l’information qui arrive au niveau des nœuds de Ranvier sous la forme de signal ionique, modulant ainsi leur état et leur interaction avec le neurone. Une altération de ce signal ionique peut maintenir les microglies dans un état pro-inflammatoire, les empêchant de jouer leur rôle pro-régénératif et pro-remyélinisant.
Dans le cas de la sclérose en plaques, cette découverte ouvre plusieurs pistes de recherche pour mieux comprendre la pathologie, notamment celle de l’impact des signaux inflammatoires existant dans cette maladie sur le dialogue neurone-microglie et le potentiel pro-remyélinisant de la microglie. La découverte de ce dialogue est d’autant plus intéressante que des thérapies à l’essai dans la sclérose en plaques tentent aujourd’hui d’agir sur la physiologie de ces microglies afin de favoriser leur caractère pro-régénératif.
Ce nouveau mode de communication mis en évidence pose aussi la question de l’impact de l’activité neuronale sur le comportement des microglies. En effet de nombreuses pathologies neurologiques, dont l’épilepsie, sont associées à des altérations de l’activité des neurones, et les conséquences de cette altération sur les cellules microgliales sont encore à ce jour inconnues.
Sources
Microglia-neuron interaction at nodes of Ranvier depends on neuronal activity through potassium release and contributes to remyelination.
https://pubmed.ncbi.nlm.nih.gov/34471138/
Ronzano R, Roux T, Thetiot M, Aigrot MS, Richard L, Lejeune FX, Mazuir E, Vallat JM, Lubetzki C, Desmazières A.Nat Commun. 2021 Sep 1