La maladie d’Alzheimer est souvent connue pour les pertes de mémoire que présentent les patients. C’est une maladie évolutive qui commence généralement par un syndrome amnésique isolé, progressif et inconnu du patient. Progressivement s’installent des troubles du langage (aphasie), de l’écriture (dysgraphie), du mouvement (apraxie), et la perte de la capacité à reconnaître des objets et des visages (agnosie).
Diagnostic
Le diagnostic de la maladie d’Alzheimer repose sur :
- Un examen clinique pour évaluer les fonctions cognitives et le comportement du patient grâce à des tests spécifiques.
- L’IRM (Imagerie par Résonnance Magnétique) qui permet de visualiser une perte de volume de l’hippocampe, région du cerveau essentielle à la mémoire, et/ou d’autres régions du cerveau
- La TEP (Tomographie par Émission de Positrons) avec du glucose qui permet de visualiser le métabolisme cérébral au cours de la maladie
- L’analyse du LCR (Liquide Céphalo-Rachidien) qui circule autour du cerveau et dans le canal central de la moelle épinière et qui est obtenu par ponction lombaire. Les variations de concentration de deux molécules dosées dans ce liquide, la protéine amyloïde et la protéine tau, sont caractéristiques de la maladie d’Alzheimer.
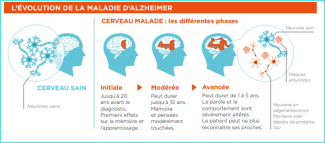
Il est classique que les médecins et chercheurs distinguent quatre stades dans la maladie d’Alzheimer :
- Le stade de troubles cognitifs légers : les symptômes comme les troubles de la mémoire sont mesurables mais n’impactent pas ou très peu le quotidien.
- Le stade dit de ‘démence légère’. Le terme démence est un terme médical signifiant simplement que les symptômes ont un retentissement sur l’autonomie du patient qui a besoin d’aide pour réaliser au moins une tâche significative au quotidien, tâche qu’il réalisait seul auparavant (par exemple payer les factures). Il a donc un sens différent du terme démence employé dans le langage courant. A ce stade, les symptômes sont plus marqués qu’initialement et commencent à handicaper le patient. La maladie peut aussi avoir commencé à se propager et à toucher d’autres fonctions comme le comportement, le langage, la vision, en plus de pertes de mémoire plus importantes. Les patients nécessitent une aide pour certaines activités quotidiennes.
- Le stade dit de ‘démence modérée’. A ce stade la maladie s’est propagée et touche plus nettement d’autres fonctions cognitives en plus de pertes de mémoire plus importantes. A ce stade, les patients nécessitent une aide pour plusieurs activités quotidiennes.
- Le stade dit de ‘démence sévère’ : La mémoire à court et long terme est lourdement atteinte. Le reste des fonctions cognitives est aussi sévèrement atteint. Le patient n’est plus autonome dans son quotidien et nécessite une aide pour des tâches élémentaires.
Il n’existe aujourd’hui pas de traitement efficace pour enrayer l’avancée de la maladie d’Alzheimer ou la guérir. Les connaissances sur ses mécanismes sont encore très partielles. Nous savons que des biomarqueurs peuvent permettre d’identifier la maladie avant l’apparition des premiers signes cliniques, grâce par exemple à des potentiels marqueurs sanguins récemment identifiés, mais le diagnostic précoce d’Alzheimer reste difficile pour les praticiens. Et lorsque les symptômes se manifestent, les patients sont atteints depuis plusieurs années, il est souvent trop tard pour agir efficacement et contrer l’évolution d’Alzheimer. La recherche sur la maladie d’Alzheimer et sa phase amont sont donc indispensables, de façon à intervenir aussi tôt que possible, et être en mesure de développer de nouveaux traitements.
La cohorte INSIGHT, suivie à l’institut de la mémoire et de la maladie d’Alzheimer par l’équipe de recherche clinique du Pr Bruno Dubois, est l’une des premières au monde à suivre près de 320 sujets sains à risque dans le but d’identifier les facteurs de déclenchement de la maladie d’Alzheimer. Les premiers de résultats de cette étude, parus début 2018, montrent, à 30 mois de suivi, que la présence de lésions amyloïdes n’a pas d’impact sur la cognition et le comportement des sujets qui en sont porteurs. Ils suggèrent l’existence de mécanismes de compensation chez les sujets porteurs de ces lésions. Cependant les sujets ayant présenté des signes de maladie d’Alzheimer durant leur suivi sont tous porteurs de ces lésions. Cette cohorte permet aux chercheurs de l’Institut du Cerveau de développer des études avec pour objectif d’identifier des « anomalies » cérébrales prédictives de la maladie d’Alzheimer, c’est-à-dire des dysfonctionnements du cerveau plus de 10 ans avant l’apparition des symptômes et le diagnostic de la maladie d’Alzheimer.
À l’Institut du Cerveau
Diagnostiquer la maladie d'Alzheimer à la phase préclinique grâce à l'électroencéphalographie
Sinead Gaubert, neurologue et chercheuse à l’Institut du Cerveau (CNRS/Inserm/Sorbonne Université) à l’hôpital Pitié-Salpêtrière, Federico Raimondo (Université de Liège/Sorbonne Université) et Stéphane Epelbaum, neurologue ont mis en évidence grâce à l’électroencéphalographie (EEG) des modifications électriques cérébrales précoces chez des sujets à la phase préclinique de la maladie d’Alzheimer, dans la cohorte INSIGHT-preAD Ces résultats extrêmement prometteurs laissent à penser que l’EEG pourrait être utilisé dans les années à venir pour dépister précocement la maladie d’Alzheimer au stade préclinique.
Pour en savoir plus : https://institutducerveau-icm.org/fr/actualite/diagnostiquer-maladie-dalzheimer-a-phase-preclinique-grace-a-lelectroencephalographie/
Identifier des profils d'évolution de la maladie
A l’Institut du Cerveau, le groupe de Lara Migliaccio dans l’équipe de Richard Lévy étudie la vulnérabilité et la résilience à la maladie, en particulier chez les sujets jeunes, et dans quelle mesure les réseaux neuronaux fonctionnels répondent à l’atteinte pathologique. L’objectif est de comprendre ce qui oriente le patient vers une pathologie plutôt focale et moins évolutive ou au contraire très diffuse avec une évolution beaucoup plus sévère, et d’identifier les caractéristiques individuelles des sujets qui jouent dans la maladie comme la qualité du sommeil, le mode de vie, l’alimentation, les activités plus ou moins intellectuelles, pour obtenir une mesure à l’échelle individuelle de ce qu’on appelle la réserve cognitive. Le défi du projet est de suivre les patients possiblement sur plusieurs années et de mettre en évidence les caractéristiques basales qui prédisent l’évolution à deux ans et extraire des mesures concrètes pour construire un algorithme de l’évolution personnalisée des patients.