Les anomalies à l’origine des maladies neurodégénératives pourraient surgir au cours du développement, c’est-à-dire des décennies avant l’apparition des premiers symptômes… Cette hypothèse gagne du terrain grâce à une nouvelle étude publiée dans Nature Communications : selon des chercheurs de l’Institut du Cerveau, la qualité des mitochondries – les centrales énergétiques des cellules – est rigoureusement contrôlée par un programme génétique spécifique qui conditionne la formation des circuits neuronaux et, à long terme, la santé du cerveau.
Le fonctionnement normal du cerveau repose sur un maillage complexe de populations de neurones organisées en réseaux, que l’on appelle les circuits cérébraux. Cette architecture délicate se forme au cours du développement sous l’influence de programmes génétiques et cellulaires minutieusement coordonnés.
Parmi les acteurs-clés de ces processus, les mitochondries jouent un rôle central – et plus particulièrement celles qui sont situées dans les axones, les longs prolongements nerveux qui relient les neurones entre eux. Les mitochondries sont responsables de la production d’ATP, l’énergie dont les cellules ont besoin pour fonctionner. Mais elles régulent également les concentrations locales de calcium, soutiennent la formation des synapses – les zones de communication entre les neurones – et participent à la plasticité du cerveau.
Jusqu’ici, on ignorait quels facteurs génétiques interviennent pour garantir que les mitochondries effectuent correctement leur travail d’architecte au cours du développement.
Des mitochondries conformes pour un développement harmonieux
Pour en savoir plus, Iryna Mohylyak, post-doctorante, et ses collègues de l’Institut du Cerveau et de l’université de Louvain ont étudié le système visuel de la drosophile, un modèle particulièrement adapté à l’étude des mécanismes moléculaires qui préludent à la formation des circuits cérébraux.
« Nous avons découvert l’existence d’un programme de régulation génétique qui contrôle la qualité des mitochondries pendant une période précise du neurodéveloppement. Lorsque ce programme est mis en sommeil, les mitochondries axonales sont anormalement grosses, et les connexions entre les neurones se dégradent fortement », explique Iryna Mohylyak.
Ce programme repose sur un facteur de transcription – baptisé Mirana (pour mitochondrial integrity regulator of neuronal architecture) – une protéine régulant l’expression de plusieurs gènes. Mirana s’active brièvement pendant la formation des circuits cérébraux, contrôle la forme des mitochondries et prépare les neurones à établir des connexions stables et efficaces tout au long de la vie.
Mirana est propre à la drosophile, mais l’équipe a identifié son homologue chez les mammifères : le facteur de transcription TZAP (Telomere-Associated Protein). Chez la souris, la perte de TZAP réduit considérablement la libération des neurotransmetteurs dans l’hippocampe.
Nous connaissions le rôle de TZAP dans la biologie des cancers, mais c’est la première fois qu’on lui découvre un rôle dans le développement des circuits cérébraux. Le programme génétique humain est vraiment fascinant : les mêmes gènes peuvent intervenir dans des contextes très différents tout au long de l’existence.
Un lien avec les maladies neurodégénératives
Parmi les gènes dont l’expression est régulée par Mirana figurent PINK1 et PARK2, qui, lorsqu’ils sont mutés, sont impliqués dans des formes précoces et familiales de la maladie de Parkinson.
« Le fait que PINK1 soit indispensable à un développement cérébral harmonieux, tout en ayant un rôle dans la maladie de Parkinson, renforce une hypothèse centrale pour notre équipe : la neurodégénérescence ne surgit pas subitement au cours du vieillissement ; elle trouve ses racines dans le neurodéveloppement », ajoute Bassem Hassan.
Chez la drosophile, l’inactivation temporaire de Mirana et PINK1 suffit à altérer durablement la connectivité cérébrale. Or, ce défaut n’est pas compensé chez l’individu adulte même si Mirana est réactivé, preuve qu’une perturbation brève durant cette fenêtre critique du neurodéveloppement peut laisser une empreinte durable sur le cerveau.
En révélant ce programme génétique de contrôle mitochondrial, les chercheurs ouvrent une voie prometteuse pour mieux comprendre, et peut-être prévenir, les maladies du cerveau dans lesquelles la communication entre les neurones accumule des anomalies dès le stade embryonnaire.
Sources
Mohylyak, I. et al. Temporal transcriptional regulation of mitochondrial morphology primes activity-dependent circuit connectivity. Nature Communications, Septembre 2025. DOI: 10.1038/s41467-025-62908-2.
Financement
Ces travaux ont été financés par le programme Investissements d’Avenir (PIA), l’Institut du Cerveau, l’Agence nationale de la recherche (ANR), l’Allen Distinguished Investigator Award, le prix de la Fondation Roger De Spoelberch et les National Institutes of Health (NIH).
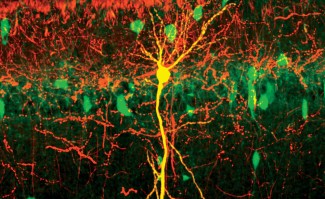
Image d’illustration
Reconstruction d'une partie du système nerveux d'une larve de drosophile (Drosophila melanogaster). Vue latérale des neurones et des synapses dans le neuropile. Crédit : Albert Cardona / Wellcome Images.
L’équipe "Développement du cerveau", dirigée par Bassem HASSAN s’intéresse à la formation des neurones et des réseaux neuronaux au cours du développement cérébral grâce à des modèles de mouches drosophile et murins. L’équipe étudie le contrôle...
En savoir plus