À l’occasion de la Journée Mondiale de la maladie de Parkinson le 12 avril, l’Institut du Cerveau - ICM fait le point sur les axes de la recherche.
Prévalence et description
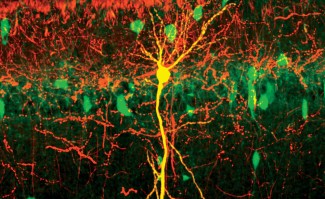
La maladie de Parkinson est la maladie neurodégénérative la plus fréquente après la maladie d’Alzheimer et la première cause de syndrome parkinsonien. Elle touche 150 000 personnes en France dont 8000 nouveaux cas chaque année. Exceptionnelle avant 50 ans, son apparition augmente après 60 ans. Son incidence est légèrement plus élevée chez les hommes que chez les femmes à tous les âges de la vie. Dépistée en 1817 par le médecin anglais James Parkinson, il s’agit d’une affection neurodégénérative chronique à évolution lente qui se caractérise par la mort d’une population de neurones, présents dans la substance noire. Ces neurones, appelés dopaminergiques, produisent une molécule chargée de transmettre l’information entre les neurones, la dopamine, neurotransmetteur indispensable au contrôle des mouvements du corps. La disparition progressive de ces neurones et par conséquent la diminution de la concentration de dopamine sont à l’origine de la maladie. Les symptômes moteurs apparaissent quand environ 60-80% de ces neurones sont détruits.
Les symptômes caractéristiques de la maladie sont essentiellement des troubles moteurs qui se traduisent par une akinésie (lenteur des mouvements), une rigidité ou hypertonie des muscles, et des tremblements lents et peu amples, signe prédominant de la pathologie.
Évolution et traitements actuels
Cette maladie entraine une invalidité et une réelle perte d’autonomie chez la personne qui en est atteinte. Plusieurs traitements sont actuellement disponibles et permettent une amélioration de la qualité de vie et une diminution des symptômes. Cependant, ces médicaments ne sont efficaces que sur une partie des patients et, fondamentalement, ne permettent pas la guérison de cette maladie. Cette situation est due en partie au diagnostic trop tardif des lésions cérébrales occasionnées, à un moment où elles sont devenues difficilement réparables. En effet, au moment des premiers symptômes de la maladie, près de 80 % des neurones de la substantia nigra (substance noire), la petite région du cerveau détruite par la maladie, sont déjà perdus. La maladie évolue dans le temps et dans l’espace : d’autres neurones vont mourir en plus des neurones dopaminergiques et les stigmates histo-pathologiques se situent d’abord dans les parties basses du cerveau puis diffusent pour atteindre le cortex cérébral à un stade avancé de la maladie. Outre la stimulation cérébrale profonde, le traitement actuel consiste à restaurer les concentrations normales de dopamine ou à utiliser des mimétiques de la dopamine appelés des agonistes. Comme pour la maladie d’Alzheimer et la plupart des grandes maladies du système nerveux, des difficultés majeures subsistent pour arriver à de nouvelles thérapies. Il faut tout d’abord comprendre au niveau cellulaire les mécanismes de la maladie pour pouvoir les bloquer. Ensuite, il faut pouvoir diagnostiquer la maladie suffisamment tôt pour que les traitements puissent être efficaces ; il faut enfin identifier les différentes formes de la maladie, chacune pouvant nécessiter un traitement particulier.
La réponse de l’Institut du Cerveau - ICM
L’espoir de bloquer la progression de la maladie de Parkinson – Interview du Dr. Étienne Hirsch
L’équipe du Pr Alexis Brice aborde la problématique de la compréhension des mécanismes avec des familles atteintes de formes familiales de la maladie de Parkinson. L’étude du patrimoine génétique de ces familles lui a déjà permis d’identifier des gènes majeurs dans le développement de la maladie, dont celui de la parkine. En identifiant le fonctionnement des protéines codées par ces gènes et leurs rôles dans les cellules nerveuses, son équipe a pu montrer des anomalies de forme et de fonction des mitochondries. Récemment, l’équipe a publié des travaux de recherche qui permettent d’identifier les étapes précoces d’un mécanisme qui pourrait être responsable de la mort neuronale dans la maladie de Parkinson.
Pour ralentir l’évolution de la maladie, l’équipe du Dr Étienne Hirsch s’est intéressée aux mécanismes moléculaires et cellulaires de la mort des neurones dopaminergiques. Si on sait qu’une concentration trop forte de calcium est impliquée dans la mort neuronale, une trop faible concentration de calcium l’est également d’où la possibilité d’utiliser des molécules qui agissent sur l’homéostasie du calcium. Ces chercheurs ont montré le rôle crucial de la neuro-inflammation dans la maladie : l’équipe a progressé dans l’étude des interactions entre les neurones dopaminergiques et les cellules du système immunitaire. En effet, les phénomènes neuroinflammatoires contribuent à perpétuer les processus de mort neuronale. Etienne Hirsch et Stéphane Hunot ont pu montrer le rôle des lymphocytes et identifier les signaux de souffrance des neurones dopaminergiques. Ces découvertes ouvrent des voies thérapeutiques prometteuses car elles permettent, sur la base d’une compréhension fine de la maladie, d’identifier les molécules efficaces pour la soigner.
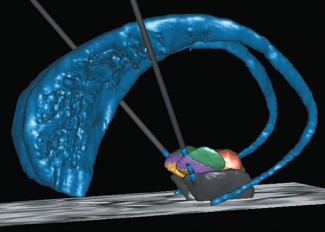
Pour affiner le diagnostic de la maladie et en séparer les différentes formes, l’équipe du Pr. Marie Vidailhet constitue des cohortes c’est à dire des groupes de patients, sains ou malades, suivies pendant plusieurs années pour identifier les marqueurs prédisant l’arrivée de la maladie, qu’il s’agisse de marqueurs sanguins, de neuroimagerie ou d’autres facteurs. Le Professeur Vidailhet est par ailleurs une experte de toutes les formes de dystonies, pour lesquelles elle a obtenu des améliorations spectaculaires en utilisant la stimulation cérébrale profonde (un dispositif miniaturisé permettant de stimuler l’action des neurones dans les régions d’intérêt du cerveau).
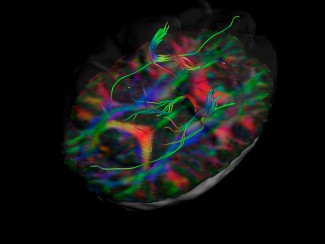
Le Pr Stéphane Lehéricy et Daniel Garcia-Lorezo, chercheur dans l’équipe de Marie Vidailhet, étudient le lien entre les troubles du sommeil paradoxal et la maladie de Parkinson. Ainsi, ils ont pu mettre en évidence un nouveau marqueur précoce dans la maladie. Ces travaux ouvrent de nouvelles possibilités de diagnostiquer de façon précoce le développement de la maladie de Parkinson.
Grâce au dialogue constant entre médecins et chercheurs, des observations cliniques ont déjà permis d’identifier des candidats médicaments prometteurs, évalués dans le Centre d’Investigation Clinique (CIC) de l’Institut du Cerveau - ICM. En janvier, sous la direction du Dr Jean-Christophe Corvol, Directeur du CIC, AETIONOMY a débuté. Ce projet vise à développer une nouvelle façon de classifier les maladies d’Alzheimer et de Parkinson dans le but d’organiser les données pour développer de nouveaux médicaments et thérapies.