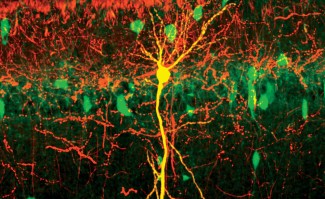
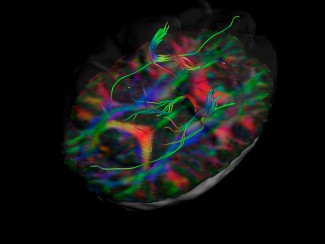
Nicolas Renier, nouveau chef d’équipe à l’Institut du Cerveau - ICM, a rejoint l’Institut le 1er janvier 2017. Ses travaux s’intéressent aux changements des connexions entre les neurones à l’âge adulte, en utilisant une technique nouvelle : l’imagerie volumétrique du cerveau par microscopie en feuillets à lumière. Ces travaux fondamentaux pourraient à terme déboucher sur des applications pour différentes maladies neurodégénératives, telles que la maladie d’Alzheimer, ou les Accidents Vasculaires Cérébraux (AVC).
En quoi vont consister vos travaux à l’Institut du Cerveau - ICM ?
Les travaux de mon équipe vont porter sur les remaniements à grande échelle de la structure des réseaux de neurones dans le cerveau adulte. Nous souhaitons savoir notamment comment les phénomènes d’apprentissages et d’adaptations du cerveau adulte se reflètent par des changements dans la morphologie et la connectivité des neurones au cours du temps.
Plus précisément nous allons aborder cette question sur deux fronts différents. Tout d’abord, d’un point de vue moléculaire et cellulaire, quels sont les facteurs qui permettent d’assurer la survie et le maintien des nombreuses branches d’un neurone adulte mature en conditions normales ? D’un point de vue dynamique, quels facteurs vont ensuite promouvoir des remaniements de la connectivité du neurone par la création de nouvelles branches, ou bien même possiblement la destruction contrôlée de certaines branches ?
Nous étudierons aussi ces phénomènes à une échelle bien plus large, en essayant de déterminer si certains changements de comportement chez le mammifère pourraient être parfois expliqués par une réorganisation massive des connexions entre des groupes spécifiques de neurones chez l’adulte.
Sur quels modèles reposeront vos travaux ?
Nous travaillons chez la souris. Nous allons nous baser sur des tâches comportementales simples, que la souris adopte naturellement, mais qui subissent des changements au cours de sa vie. Nous étudierons comment leur cerveau change et s’adapte pour permettre au cours du temps à l’animal d’effectuer de nouvelles tâches. Grâce aux techniques d’imagerie et de génétique employées, nous espérons pouvoir décrire les changements dans l’organisation de certains circuits neuronaux très précisément.
Un exemple très frappant est celui de l’évolution des comportements parentaux de la souris. Avant d’avoir des petits, les souris mâles sont indifférentes voire agressives envers les jeunes. Mais après un premier accouplement, une transition de comportement s’opère, et la souris tolère la présence des petits. Le temps que prend ce changement de comportement correspond exactement au temps de gestation. Cela signifie que quand les petits arrivent la souris mâle est prête pour vivre à leurs côtés, voir même participer aux tâches parentales. On ne sait pas encore précisément de quelle nature sont les changements dans l’organisation des connections entre neurones qui pourraient expliquer cette adaptation dans le comportement. Nous allons donc explorer quelles sont les modifications de projections axonales dans le cerveau qui supportent ce type de transitions de comportement, et au niveau moléculaire quelles sont les protéines qui contrôlent la création et la destruction de branches neuronales.
Cela s’apparente à l’étude du guidage des axones ou de la migration des neurones lors du développement embryonnaire. Cependant, dans le cerveau adulte nous travaillons sur un environnement relativement figé en comparaison à l’exubérance des mouvements cellulaires chez l’embryon. Notre espoir est que le potentiel de faire et défaire des connections entre neurones à grande échelle existe toujours dans le cerveau adulte. C’est un phénomène qui s’étudie à différentes échelles, et que l’on appelle la plasticité cérébrale.
Vos travaux auront-ils un intérêt pour faire progresser les connaissances sur certaines maladies neurologiques ?
Notre thématique est très fondamentale mais peut déboucher sur des applications médicales à terme : nos travaux pourraient permettre par exemple de mieux comprendre les mécanismes de dégénérescence des neurones dans les maladies neurodégénératives. Certains processus contrôlant en situation normale la stabilité de chaque branche d’un neurone peuvent par exemple s’emballer et entrainer une dégradation des neurones ou de leurs branches en situation pathologique.
Aussi, si nous comprenions comment se développent de nouvelles connexions à longue distance entre des neurones adultes matures, nous pourrions essayer de promouvoir le rétablissement de projections dans des régions du cerveau devenues silencieuses après une lésion ou un accident vasculaire cérébral (AVC).
A la suite d’un AVC, il est observé une mort neuronale et une perte d’activité générale dans la région affectée. Nos études pourraient permettre d’identifier de nouvelles cibles moléculaires, afin de promouvoir le re-cablage de ces régions devenue silencieuses par les régions adjacentes.
Les phénomènes de mort neuronale sont aussi bien entendu une des caractéristiques majeures des maladies neurodégénératives. La dégradation du tissu cérébral au travers de problèmes affectant la glie, la vascularisation, potentiellement l’accumulation de plaques, etc. peuvent entraîner la mort des neurones. Plusieurs équipes pensent aujourd’hui que la perte neuronale pourrait être un processus actif de destruction des neurones et de leurs axones, au-delà de simplement d’une mort « passive » due la dégradation de leur environnement. Chez un patient, même en stade précoce d’Alzheimer par exemple, il serait possible qu’une dégradation active des connexions entre les neurones soit en cours, un phénomène qui pourrait être en continuité avec les mécanismes « physiologiques » de remaniement des axones que nous allons tenter d’élucider.
Notre travail se situe donc en amont et en périphérie des recherches portant sur les causes et traitements de ces maladies, et nous espérons pouvoir interagir de manière proche avec les autres équipes de l’Institut du Cerveau - ICM travaillant directement sur ces thématiques.
Utilisez-vous une méthode d’étude particulière ?
Notre outil principal est l’imagerie volumétrique du cerveau par microscopie en feuillets à lumière. Cette méthode d’imagerie est en plein essor. Elle repose sur l’obtention d’échantillons transparents, et j’ai eu l’opportunité de pouvoir participer au développement des protocoles et méthodes d’analyse aux Etats-Unis, à l’Université de Rockefeller. Le protocole que j’ai mis en place avec mes collègues permet de marquer spécifiquement certains neurones dans un cerveau intact, puis de l’imager en le rendant optiquement transparent par un procédé chimique, tout en le conservant intact. Grâce aux outils de la biologie moléculaire et de la génétique, nous pouvons révéler spécifiquement des circuits neuronaux avec une précision et une reproductibilité élevées, et ensuite les observer en trois dimensions grâce à la microscopie en feuillet de lumière.
Plus précisément, la technique de microscopie consiste à scanner le cerveau avec un faisceau laser plan, un peu comme si l’on faisait des coupes dans l’échantillon. Comme cette feuille de lumière peut se déplacer très vite de haut en bas, nous gagnons beaucoup de temps par rapport aux microscopes classiques qui travaillent point par point dans l’espace 3D. Tout notre projet repose sur cette nouvelle capacité technologique d’imager à très haut débit les cerveaux.
Cela permettra de faire un traitement statistique des données, ce qui est difficile lorsque l’on travaille traditionnellement en coupes. Il existe effectivement déjà beaucoup de techniques de cartographie basées sur l’obtention de coupes physiques de l’échantillon. Dans notre cas, en une heure on peut scanner un cerveau entier, en gardant l’échantillon intact, donc pouvant être imagé à nouveau, ce qui permet d’avoir une image continue des échantillons. L’Institut est en train d’acheter tout le matériel nécessaire pour effectuer ce nouveau type d’imagerie.
Vos travaux semblent partager plusieurs points communs avec ceux de l’équipe de Bassem Hassan, est-ce le cas ?
Effectivement, d’ailleurs nous faisons partie avec l’équipe de Bassem Hassan d’un même axe thématique assez nouveau dans l’Institut. Nous avons des intérêts proches concernant le développement du système nerveux et l’origine des neurones, mais aussi les liens entre le développement de la morphogénèse et des projections d’un neurone et l’influence que cela peut avoir sur le comportement. L’équipe de Bassem Hassan s’intéresse à la variabilité interindividuelle du comportement chez la drosophile, et au substrat neuronal de ces comportements. Cela rejoint certains concepts que nous aimerions beaucoup commencer à explorer chez la souris.
Quel a été votre parcours avant d’arriver à l’Institut du Cerveau - ICM ?
J’ai fait la plupart de mes études à Paris, et notamment ma thèse, à l’Institut de la Vision, avec Alain Chédotal, qui travaille sur le développement du système nerveux et le guidage axonal. J’avais donc déjà un intérêt fort pour cette thématique à l’époque, où je cherchais à comprendre comment les erreurs de guidage durant le développement étaient ensuite corrigés par la plasticité des réseaux à l’âge adulte. Pour mon post-doctorat j’ai rejoint à New York dans l’Université de Rockefeller, le laboratoire de Marc Tessier-Lavigne, qui est très connu pour ses travaux sur les molécules de guidage axonal.
C’est justement en voulant visualiser au mieux les axones des neurones pendant le développement que j’ai été amené à développer des améliorations pour les techniques d’imagerie tridimensionnelle existantes, et ma mission a consisté en très grande partie à faire des développements techniques pour permettre aux techniques d’imagerie 3D par microscopie en feuillets à lumière d’être utilisées en neurosciences pour l’étude des circuits neuronaux dans des cerveaux intacts.
Aujourd’hui, à l’Institut du Cerveau - ICM, je souhaite poursuivre mes recherches, en essayant d’exploiter au maximum cette technique pour faire de nouvelles découvertes sur le développement de la connectivité des neurones chez l’adulte.